溶解度
この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2017年12月) |
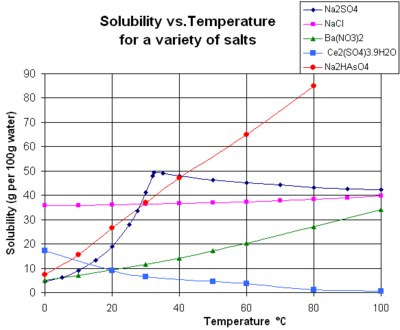
溶解度(ようかいど、solubility)とはある溶質が一定の量の溶媒に溶ける限界量をいう。飽和溶液の濃度である。通常、Sという記号で表される。
固体の溶解度は、一定温度で、溶媒100 gに溶ける溶質の質量[g]や、飽和溶液100 gに溶けている溶質の質量[g]などで表す。本来は無名数であるが、一般に[g/100g-溶媒の化学式]等の単位を付して表す。この場合、溶媒が水なら[g/100g-H2O]となる。溶解度は温度によって変化し、固体に関しては、例外もあるが、温度が上がると溶解度が上がるものが多い。
気体の溶解度は一定温度で、1 atm(1気圧)の気体が溶媒1 mlに溶ける体積を標準状態(STP)に換算して表す。この溶解度は温度によって変化する。
化学の金言として「似たものは似たものを溶かす」と言われる[1]。これが意味するところは、極性分子は極性分子(水)に溶解し、非極性分子は非極性溶媒(例えば油)に溶解するという傾向のことである。このため溶媒同士でも水と油は溶けあわず分離し、水とエタノールではよく混和する。
出典
^ L.F.フィーザー、K.L.ウィリアムソン 2000, p. 34.
参考文献
L.F.フィーザー、K.L.ウィリアムソン 『フィーザー/ウィリアムソン有機化学実験』 丸善、2000年、第8版。ISBN 4-621-04734-5。 Organic experiments, 8th ed, 1998.
関連項目
- 溶解度の一覧
- 溶解度曲線
- 溶解
- ヘンリーの法則