蒸気圧
蒸気圧(じょうきあつ、英語: vapor pressure)、あるいは平衡蒸気圧(へいこうじょうきあつ、英語: equilibrium vapor pressure)とは、液相あるいは固相にある物質と相平衡になるような、その物質の気相の圧力のことである。蒸気圧は物質に特有の物性値であり、温度に依存して決まる。
物質の沸点とは、その物質が液相にあるときの蒸気圧が外圧に等しくなる温度である。また、物質の昇華点とは、その物質が固相にあるときの蒸気圧が外圧に等しくなる温度である。さらに物質が液相と固相の平衡状態にあるときの蒸気圧が外圧に等しくなる温度は三重点と呼ばれる。
液体の物質の周囲でのその物質の蒸気の分圧が液相の蒸気圧に等しいとき、その液体は蒸気と気液平衡の状態にある。
気液平衡から温度を上げると蒸気圧が上がり、蒸気の分圧より大きくなる。蒸気を理想気体とみなせば、分圧は蒸気量に比例する。液体が蒸発することで蒸気量が増えて分圧も上がり、新たな温度での蒸気圧と等しくなることで再び気液平衡となる。逆に温度を下げると蒸気圧が下がる。このときは蒸気が液体に凝縮することで分圧が下がり、新たな温度で気液平衡となる。気相と固相の相平衡でも同様に、温度の変化に対して物質が昇華して分圧が蒸気圧と等しくなるように蒸気量が変化して平衡が保たれる。
純物質の蒸気圧はクラウジウス・クラペイロンの式によって近似される。溶液であれば蒸気圧降下が起こり、これはラウールの法則で近似される。
目次
1 理想的な水の蒸気圧
2 蒸気圧の例
3 気象学における蒸気圧
4 曲面上の蒸気圧
5 出典
6 関連項目
理想的な水の蒸気圧
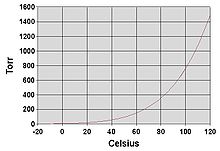
水の蒸気圧を縦軸、温度を横軸に取ったグラフ。水は標準大気圧(1気圧)の下でおよそ100度で沸騰する。この時の蒸気圧は1気圧に等しい。
他の液体と同様に蒸気圧が周囲の大気圧まで達すると水は沸騰する。高度が高い場所では大気圧が低くなるため、水は低い温度で沸騰する。大気圧 P と水の沸点 θbp の関係は
log10(P/Torr)=8.07131−1730.63233.426+θbp/∘C{displaystyle log _{10}(P/{text{Torr}})=8.07131-{frac {1730.63}{233.426+theta _{text{bp}}/{}^{circ }{text{C}}}}}
θbp/∘C=1730.638.07131−log10(P/Torr)−233.426{displaystyle theta _{text{bp}}/{}^{circ }{text{C}}={frac {1730.63}{8.07131-log _{10}(P/{text{Torr}})}}-233.426}
によって近似される。この近似式はアントワン式と呼ばれる実験式である。
用いる単位と対数の底によって各係数が異なり、上の式では大気圧 P にトル(Torr)、沸点 θbp にセルシウス度(°C)を用いており、常用対数であることに注意。
| 温度 θ /°C | 水の蒸気圧 f /hPa | 温度 θ /°C | 水の蒸気圧 f /hPa |
|---|---|---|---|
| 0 | 6.10 | 80 | 475 |
| 5 | 8.71 | 90 | 701 |
| 10 | 12.25 | 100 | 1013 |
| 15 | 17.01 | 110 | 1432 |
| 20 | 23.32 | 120 | 1989 |
| 30 | 42.31 | 130 | 2710 |
| 35 | 56.04 | 140 | 3631 |
| 40 | 73.48 | 150 | 4791 |
蒸気圧の例
以下の表は幾つかの物質の 25 ℃における蒸気圧を昇順に並べたリストである。
| 物質 | 蒸気圧 | ||
|---|---|---|---|
p / Pa | p / bar | p / Torr | |
グリセリン[1] | 0.02 | 2×10−7 | 0.0002 |
水銀[2] | 0.3 | 3×10−6 | 0.002 |
エチレングリコール[3] | 6 | 6×10−5 | 0.05 |
ドデカン[4] | 0.02×103 | 2×10−4 | 0.1 |
デカン[4] | 0.2×103 | 0.002 | 1 |
二フッ化キセノン[5] | 0.6×103 | 0.006 | 5 |
1-ブタノール[3] | 0.9×103 | 0.009 | 7 |
メチルイソブチルケトン[6] | 2.6×103 | 0.026 | 20 |
1-プロパノール[7] | 2.8×103 | 0.028 | 21 |
水(H2O)[4] | 3.2×103 | 0.032 | 24 |
エタノール[3] | 7.8×103 | 0.078 | 59 |
メタノール[3][4] | 17×103 | 0.17 | 130 |
フロン113[4] | 45×103 | 0.45 | 340 |
アセトアルデヒド[8] | 0.12×106 | 1.2 | 900 |
ブタン[4] | 0.24×106 | 2.4 | 1800 |
プロパン[4] | 0.95×106 | 9.5 | 7100 |
硫化カルボニル[4] | 1.3×106 | 13 | 9600 |
エタン[4] | 4.2×106 | 42 | 31000 |
二酸化炭素[4] | 6.4×106 | 64 | 48000 |
気象学における蒸気圧
気象学において蒸気圧という用語は、空気中の水蒸気分圧に対して用いられ[9]、水蒸気が気液平衡にあるとは限らない。
気液平衡にあるときの水蒸気分圧は平衡蒸気圧、あるいは飽和蒸気圧と呼ばれる。ただし飽和蒸気圧という用語は、水面あるいは海面の直上の大気中に含まれる霧状の水(液体)を算入する場合がある[10]。
曲面上の蒸気圧
液滴など、液面が曲率を持つ場合、蒸気圧pd は表面張力の影響を受け、次のトムソン・ギブスの式(en:Ostwald–Freundlich equation)で与えられる[11]。ケルビン方程式も参照。
- pd=psexp(2γMaρRT)=psexp(2γvmakT){displaystyle p_{d}=p_{s}exp left({frac {2gamma M}{arho RT}}right)=p_{s}exp left({frac {2gamma v_{m}}{akT}}right)}
ここで
ps :平面上の飽和蒸気圧- γ:表面張力
M :分子量
a :半径- ρ:密度
R :気体定数
T :温度
vm :分子容
k :ボルツマン定数
である。
出典
^ Sergey P. Verevkin, Dzmitry H. Zaitsau, Vladimir N. Emel’yanenko, Aleksandra A. Zhabina (2015年). “Thermodynamic properties of glycerol: Experimental and theoretical
study”. Fluid Phase Equilibria 397: 87–94. doi:10.1016/j.fluid.2015.03.038.
^ “mercury”. NIST. 2016年9月30日閲覧。
- ^ abcd“[http://ddbonline.ddbst.com/AntoineCalculation/AntoineCalculationCGI.exe Vapor Pressure
Calculation by Antoine Equation]”. DDBST.com. 2016年9月30日閲覧。
- ^ abcdefghij“Thermophysical Properties of Fluid Systems”. NIST. 2016年9月30日閲覧。
^ Melita Tramšek, Boris Žemva (2006年). “Synthesis, Properties and Chemistry of Xenon(II) Fluoride” (PDF). Acta Chim. Slov 53: 105–116. http://acta-arhiv.chem-soc.si/53/53-2-105.pdf 2016年9月30日閲覧。.
^ “Methyl Isobutyl Ketone”. NIST. 2016年9月30日閲覧。
^ “1-Propanol”. NIST. 2016年9月30日閲覧。
^ “Acetaldehyde”. NIST. 2016年9月30日閲覧。
^ “Glossary”. アメリカ気象学会. 2011年4月23日閲覧。
^ Steven M. Babin, MD, PhD. “A Brief Tutorial”. 2011年4月23日閲覧。
^ 高橋幹二、日本エアロゾル学会編、 『エアロゾル学の基礎』 森北出版、2003年、165頁。ISBN 4-627-67251-9。
関連項目
| ||||||||||||


