水素結合

自己組織化二量体複合体における分子間水素結合の例[1]。点線が水素結合を示す。
アセチルアセトンにおいてエノール互変異性体を安定化させる分子内水素結合の例
水素結合(すいそけつごう、英: hydrogen bond)は、電気陰性度が大きな原子(陰性原子)に共有結合で結びついた水素原子が、近傍に位置した窒素、酸素、硫黄、フッ素、π電子系などの孤立電子対とつくる非共有結合性の引力的相互作用である。水素結合には、異なる分子の間に働くもの(分子間力)と単一の分子の異なる部位の間(分子内)に働くものがある[2]。
水素結合はもっぱら、陰性原子上で電気的に弱い陽性 (δ+) を帯びた水素が(右上図:水分子の例)周囲の電気的に陰性な原子との間に引き起こす静電的な力として説明されることが多い。つまり、双極子相互作用のうち、特別強いもの、として考えることもできる。ただし水素結合はイオン結合のような無指向性の相互作用ではなく、水素・非共有電子対の相対配置にも依存する相互作用であるため、水素イオン(プロトン)の「キャッチボール」と表現されることもある。
典型的な水素結合(5〜30 kJ/mol)は、ファンデルワールス力より10倍程度強いが、共有結合やイオン結合よりはるかに弱い。水素結合は水などの無機物においても、DNAなどの有機物においても働く。水素結合は水の性質、たとえば相変化などの熱的性質、あるいは水と他の物質との親和性などにおいて重要な役割を担っている。
2011年に、国際純正・応用化学連合(IUPAC)によって作られたタスクグループは、以下のような水素結合の現代的な定義を提案している。
| 「 | 水素結合とは、分子中の水素原子、またはXがHよりも電気陰性度が高い分子断片X–H中の水素原子と、同じまたは異なる分子中の原子または原子のグループとの間の引力的相互作用で、結合が形成されている証拠があるもののことである。 The hydrogen bond is an attractive interaction between a hydrogen atom from a molecule or a molecular fragment X–H in which X is more electronegative than H, and an atom or a group of atoms in the same or a different molecule, in which there is evidence of bond formation. | 」 |
—IUPAC Technical Report[3][4] | ||
目次
1 効果と役割
2 結合
3 歴史
4 水における水素結合
5 水における二股状および過剰配位水素結合
6 DNAおよびタンパク質における水素結合
7 ポリマーにおける水素結合
8 対称性を持つ水素結合
9 二水素結合
10 水素結合に関する先進的な理論
11 水素結合による事象
12 脚注
13 参考文献
14 関連項目
効果と役割

水分子の極性

水中における水素結合ネットワークの模式図。赤は酸素原子、青が水素原子、黄実線が共有結合、黒点線が水素結合を示す
水が同族の他の第16族元素の水素化物(H2S〔沸点: −60.7 ℃〕など)より比較的高い沸点(100 ºC)を示すのは、水素結合によって分子間の引力が非常に強くなるためである。また、水が氷に変化する際に体積が増大するのは、水分子の三角構造が水素結合で蜂の巣状になり、そこに空洞が多く生まれるためである。
生体高分子において水素結合は、タンパク質が二次構造以上の高次構造を形成する際や、核酸の中で核酸塩基同士が相補的に結びつき二重らせん構造が形成する際に必要な、重要な駆動力となっている。
近年では炭素上の水素が陰性原子と作る相互作用(CH-O、CH-N相互作用)や、芳香環と水素との相互作用(CH-π相互作用)も弱い水素結合として認識されるようになってきた[5]。
結合
相対的に電気陰性度が高い原子と共有結合を形成している水素原子は、水素結合供与体 (donor、ドナー) である[6]。この場合の陰性原子はフッ素、酸素、窒素などである。フッ素、酸素、窒素などの陰性原子は、水素原子と共有結合しているかいないかにかかわらず、水素結合受容体 (acceptor、アクセプター) となる。水素結合供与体の一つの例は、酸素原子と共有結合した水素原子を有するエタノールである。共有結合した水素原子を持たない水素結合受容体の一つの例は、ジエチルエーテルの酸素原子である。
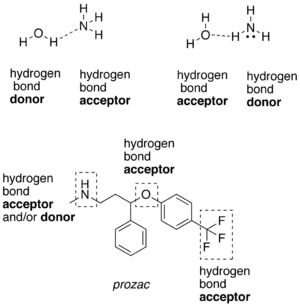
水素結合供与体 (hydrogen bond donor) と受容体 (acceptor) の例。下部の化合物は抗うつ薬のフルオキセチン (prozac)。

カルボン酸は気相においてしばしば二量体を形成する。点線は水素結合を示す。
炭素原子に結合した水素原子も、クロロホルム (CHCl3) のように、炭素原子が陰性原子と結合している場合は、水素結合に関与することができる。陰性原子によって、水素原子核の周りの電子雲が分散・引き付けられ、水素原子は部分正電荷を帯びる。水素原子は他の原子や分子と比較して小さいため、生じた電荷や、部分電荷だけでも大きな電荷密度を示す。この強い正電荷密度が、水素結合受容体となるヘテロ原子中の非共有電子対と引き付け、水素結合が形成される。
水素結合はしばしば、静電的な双極子-双極子相互作用として説明される。しかしながら、水素結合は指向性を持ち強力であり、ファン・デル・ワールス半径より短い原子間距離を示し、原子価の一種と解釈される限られた数の相互作用しか大抵形成しないなど、共有結合的な性質も持っている。これらの共有結合様の性質は受容体がより電気陰性なドナー中の水素原子と結合する時により顕著である。
水素結合の部分的な共有結合性は以下のような疑問を提起する: どちらの分子あるいは原子に水素原子核は属しているのだろうか? どちらが供与体でどちらが受容体なのだろうか? 通常は、これらは、単純に X—H...Y 系の原子間距離に基づいて決定される。X—Hの距離は、通常 〜110 pmであるが、H...Yの距離は 〜160から200 pmである。水素結合を示す液体は会合液体 (associated liquids) と呼ばれる。
水素結合の強さは、とても弱いもの (1-2 kJ mol−1) から、HF2−[7]のように非常に強いもの (>155 kJ mol−1) まで、様々である。
気相における典型的なエンタルピーは、
- F—H...:F (155 kJ/mol あるいは 40 kcal/mol)
- O—H...:N (29 kJ/mol あるいは 6.9 kcal/mol)
- O—H...:O (21 kJ/mol あるいは 5.0 kcal/mol)
- N—H...:N (13 kJ/mol あるいは 3.1 kcal/mol)
- N—H...:O (8 kJ/mol あるいは 1.9 kcal/mol)
- HO—H...:OH3+ (18 kJ/mol[8] あるいは 4.3 kcal/mol)
である。
水素結合の長さは、結合の強さ、温度、圧力に依存している。結合の強さ自身は、温度、圧力、結合角度、局所的な誘電率などの環境に依存している。典型的な水における水素結合の長さは197 pmである。理想的な結合角度は水素結合供与体の性質に依存している。以下のフッ化水素酸供与体と様々な受容体との水素結合角度は実験的に決定されたものである[9]。
| 受容体···供与体 | 原子価殻電子対反発則 (VSEPR) | 角度 (°) |
| HCN···HF | 直線形 | 180 |
| H2CO ··· HF | 平面三角形 | 110 |
| H2O ··· HF | 四角錐形 | 46 |
| H2S ··· HF | 四角錐形 | 89 |
| SO2 ··· HF | 三角錐形 | 145 |
歴史
ライナス・ポーリングは著作 The Nature of the Chemical Bond の中で、1912年に水素結合について初めて述べた人物としてT. S. MooreとT. F. Winmillを挙げている[10]。MooreとWinmillは水素結合を、水酸化トリメチルアンモニウムが水酸化テトラメチルアンモニウムよりも弱い塩基であることを説明するために使用した。よりよく知られた状態である水における水素結合に関しては、少し遅れて1920年にウェンデル・ラティマーとウォース・ローデブッシュによって言及されている[11]。この論文において、ラティマーとローデブッシュは、彼らの研究室の研究員であるモーリス・ハギンズの未発表の成果を引用して、「未発表のいくつかの研究において本研究室のハギンズ氏は、ある有機化合物に関する理論として、2つの原子間の水素カーネルのアイデアを用いている。 "Mr. Huggins of this laboratory in some work as yet unpublished, has used the idea of a hydrogen kernel held between two atoms as a theory in regard to certain organic compounds."」と述べている[11]。
水における水素結合
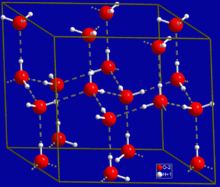
六方晶系氷の結晶構造。灰色の点線が水素結合を示す。

水分子間の水素結合のモデル。
最も普遍的に、そしておそらく最も単純な水素結合の例は、水分子と水分子の間に見られる。個々の水分子には、2個の水素原子と1個の酸素原子が存在する。2つの分子しか存在しない最も単純な場合において、水2分子は1個の水素結合を形成できる。このような場合は、水二量体 (water dimer) と呼ばれ、しばしばモデルシステムとして用いられる。液体の水の場合のように、より多くの分子が存在する時は、水1分子の酸素原子は2つの非共有電子対を持ち、それぞれの非共有電子対が別の水分子の水素原子と1つの水素結合を形成できるため、より多くの水素結合を形成することが可能である。これが繰り返されることによって、図に示されているように、一つの水分子は4つまでの他分子と水素結合を形成できる。水素結合は氷の結晶構造に多大な影響を与えており、六方格子の構築に寄与している。氷の密度は同じ温度において水よりも小さく、故に、他のほとんどの物質とは異なり、水の固相状態は液体の水に浮く。
液体の水の高い沸点は、低い分子量に比べて、それぞれの分子が多くの水素結合を形成できることが原因である。この水素結合ネットワークを壊すことが困難なため、水は他の水素結合を形成しない同様の液体と比較して、非常に高い沸点や融点、粘度を示す。水は、その酸素原子が2つの非共有電子対と2つの水素原子を持っているため、1つの水分子で4つまでの水素結合を形成できる点で特徴的である。例えば、フッ化水素は、フッ素原子が3つの非共有電子対と1つの水素原子を持っているが、水素結合を2つしか形成できない(アンモニアでは、3つの水素原子を持っているが1つの非共有電子対しかないという逆の問題がある)。
- H−F⋅⋅⋅H−F⋅⋅⋅H−F{displaystyle {ce {H-F^{...}H-F^{...}H-F}}}
液体状態の水1分子が形成できる水素結合の厳密な数は、時間によって変動し、温度に依存する。TIP4Pモデルを用いた25 ºCにおけるシミュレーションでは、それぞれの水分子は平均して3.59個の水素結合に関与していると予測されている[12]。100 ºCでは、この数は分子運動の増大と密度の低下によって3.24個に減少するが、0 ºCでは水素結合の平均数は3.69個に増加する[12]。より最近の研究では、25 ºCにおける水素結合の数は2.357個とかなり少なく見積もられている[13]。この違いは、水素結合の定義と計測に異なる手法を用いているためではないかと考えられる。
水素結合の強さがより同等の時は、2つの相互作用してる水分子の原子は、2つの異なる電荷を持つ多原子イオン(水酸化物イオン OH− とヒドロニウムイオン H3O+)に別れる。
- H−O−H3O+{displaystyle {ce {H-O^{-}H3O^{+}}}}
実際に、標準状態における純粋な水では、このようなイオンの形成はほとんど起こらず、この状態における水の解離定数に従うと、5.5 × 108分子中で1分子のみである。これが水の特異性の最も重要な部分である。
水における二股状および過剰配位水素結合
単一の水素原子は1つではなく2つの水素結合に関与することができる。このようなタイプの水素結合は、二股状 (bifurcated) あるいは三中心型と呼ばれる。例えば、これらは天然あるいは合成有機分子の複合体中に存在している[14]。二股状水素結合は、水の再配向に必須の段階であることが示唆されている[15]。受容体型の水素結合(酸素原子の非共有電子対で終了する)は、供与体型(同じ酸素原子と結合した水素原子で始まる)よりも二股状水素結合を形成しやすい(過剰配位酸素、overcoordinated oxygen, OCO)[16]。
DNAおよびタンパク質における水素結合

DNAにおける2つの塩基対の内の1つであるグアニンとシトシン間の水素結合。
水素結合は、タンパク質や核酸がとる三次元構造の決定にも重要な役割を果たしている。高分子は、同一の高分子中の異なる部分間の水素結合によって、高分子の生理学的あるいは生化学的役割を決定しているある特異的な形状へと折り畳まれる。例えば、DNAの二重螺旋構造は、一方の相補鎖ともう一方の鎖との間の塩基対の水素結合に大部分よっており、DNAの複製を可能にしている。
タンパク質の二次構造では、主鎖の酸素原子とアミド結合の水素原子との間で水素結合が形成される。水素結合に関与しているアミノ酸残基の間隔がi と i + 4の時は、αヘリックスが形成される。間隔がi と i + 3のようにより短い時は、310ヘリックスが形成される。2つのペプチド鎖が水素結合によって会合する時は、βシートが形成される。水素結合は、Rグループの相互作用を通じて、タンパク質の四次構造の形成にも部分的に寄与している(フォールディングを参照)。
ポリマーにおける水素結合
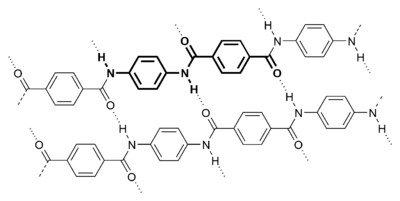
パラ-アラミド構造

セルロース鎖(Iαコンホメーション)。セルロース分子間の点線は水素結合を示す。
多くのポリマーは、主鎖における水素結合によって強化されている。合成ポリマーの中では、最もよく知られた例はナイロンである。ナイロンでは、反復単位 (repeat unit) の中で水素結合が存在し、物質の結晶化において主要な役割を果たしている。アミド反復単位中のカルボニル基とアミノ基の間で水素結合が形成される。これらは効果的に隣接した鎖を結び付け結晶を作り、物質の強化を助ける。この効果は、水素結合が直鎖を横方向に安定化しているアラミド繊維で最大である。鎖軸は、繊維軸に沿って整列し、繊維を極めて硬くかつ強くしている。水素結合はセルロースや、天然において様々な形で存在している木材や綿、亜麻などの天然繊維等のセルロース派生物の構造においても重要である。
水素結合ネットワークは、天然および合成ポリマーを共に大気中の湿度のレベルに敏感にしている。これは、水分子が表面から拡散し、水素結合ネットワークを壊すためである。ナイロンはアラミドよりも感受性が高く、ナイロン6 (nylon 6) はナイロン11よりも感受性が高い。
対称性を持つ水素結合
対称性を持つ水素結合は、プロトンが2つの同一の原子間のちょうど半分に位置している特別な水素結合のタイプである。それぞれの原子間の水素結合の強さは等しい。これは三中心四電子結合の一つの例である。このタイプの水素結合は「普通」の水素結合よりも強い。有効結合次数は0.5であり、共有結合に匹敵する強さがある。このタイプの水素結合は高圧下での氷 (Ice X) や、その他にも高圧下におけるフッ化水素酸や蟻酸などの無水の酸の固相状態において見られる。また、ビフルオリドイオン [F-H-F]−でも見られる。対称性を持つ水素結合は、最近、高圧下 (> GPa) のギ酸において分光学的に観測されている。それぞれの水素原子は、1つではなく2つの原子と部分共有結合を形成している。
低障壁水素結合 (Low-barrier hydrogen bond, LBHB) は2つのヘテロ原子間の距離が非常に小さい時に形成される。
二水素結合
水素結合は、よく似た二水素結合と比較される。二水素結合もまた、水素原子が関与した分子間相互作用である。これらの構造は、X線結晶学によって明らかにされている[17]。しかしながら、二水素結合と通常の水素結合、イオン結合、共有結合との関係の理解については不明なままである。一般的に、水素結合は、非金属元素(窒素原子やカルコゲン類元素など)中の非共有電子対によるプロトン受容体によって特徴付けられる。ある場合においては、π結合や金属錯体がこれらのプロトン受容体になりうる。二水素結合では、しかしながら、金属ヒドリドがプロトンアクセプターとして働くことによって、水素-水素相互作用が形成される。これらの複合体での分子構造は、結合長が金属錯体/水素供与体系に非常に適応性があるという点において、水素結合と似ていることが、中性子回折法によって明らかにされている[17]。
水素結合に関する先進的な理論
1999年に、Issacらは、通常の氷のコンプトンプロファイルにおける異方性 (anisotropy) の解釈から、水素結合は部分的に共有結合性があると証明した[18]。タンパク質における水素結合のいくつかのNMRデータも共有結合性を示している。
最も一般的には、水素結合は2つあるいはそれ以上の分子間結合の距離依存的静電スカラー場として記述される。これは、共有結合やイオン結合における分子間束縛状態とは若干異なっている。しかしながら、相互作用エネルギーが合計すると負の値を取るため、水素結合は通常束縛状態の現象である。ライナス・ポーリングによって提唱された初期の水素結合理論では、水素結合が部分的に共有結合性を持っていることが示唆されている。これは、1990年代後半にF. CordierによってNMR法が適用され、水素結合した原子核の間で情報が転送されることが示されるまで論争の的であった[19][20][21]。この情報の移動は水素結合が共有結合性を含んでいる時にしか起きない。水における水素結合について多くの実験データが分子間距離のスケールや分子熱力学についてよい解答を与えたが、動的システムにおける水素結合の分子運動や動力学の性質については未解決のままである。
水素結合による事象
NH3、H2O、HFの、それぞれ対応する重アナログPH3、H2S、HClに比べて劇的に高い沸点。- 無水リン酸およびグリセロールの粘性の高さ
- カルボン酸の二量体形成と、フッ化水素の六量体形成。気相においても起こり、理想気体の状態方程式からのズレが生じる。
- 非極性溶媒中における水やアルコールの五量体形成
- アンモニアなど多くの化合物の水への高い溶解性
- フッ化水素と水の混合物の負の共沸
NaOHの潮解は、OH−と湿気との反応による水素結合性H3O2−の形成に部分的に起因している。同様のプロセスは、NaNH2とNH3間、NaFとHFでも起こる。- 水素結合によって安定化された結晶構造による氷の水より小さい密度
- 水素結合の存在は、ある特定の化合物の混合物において、物質の状態の通常の遷移に異常性を引き起こす。これらの化合物は、ある温度までは液体で存在し、次に温度が上昇しても固体となり、最後に温度が異常な中間段階を越えると再び液体となる[22]。
- スマートラバー (smart rubber) は、水素結合をまさに結合させるために利用している。スマートラバーは、同一のポリマーの2つの表面の間でその場で水素結合が形成され、破れても「回復」する。
- ナイロンとセルロース繊維の強度
- ウールでは、タンパク質繊維が水素結合によって集合しており、延ばした時に戻る原因となる。しかしながら、高温で洗浄すると、この水素結合が永久に失われ、衣服の形が元に戻らなくなる。
脚注
^ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). “Self-Complementarity Achieved through Quadruple Hydrogen Bonding”. Angew. Chem. Int. Ed. 37: 75–78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "hydrogen bond".
^ E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenberg, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci and D. J. Nesbitt. “Definition of the Hydrogen Bond”. 2011年3月13日閲覧。
^ IUPAC Physical and Biophysical Chemistry Division (2011年11月10日). “Definition of the hydrogen bond”. Provisional Recommendations. 2011年3月13日閲覧。
^ Desiraju, G. R.; Steiner, T. (1999). The Weak Hydrogen Bond: in Structural Chemistry and Biology. ICUr monographs on crystallography 9. Oxford: Oxford Univ. Press. ISBN 978-0198502524.
^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6. http://www.phschool.com/el_marketing.html.
^ Emsley, J. (1980). “Very Strong Hydrogen Bonds”. Chem. Soc. Rev. 9: 91–124. doi:10.1039/cs9800900091.
^ Omer Markovitch and Noam Agmon (2007). “Structure and energetics of the hydronium hydration shells”. J. Phys. Chem. A 111 (12): 2253–2256. doi:10.1021/jp068960g. PMID 17388314.
^ A. C. Legon;D. J. Millen. (1987). Chem. Soc. Rev. 16: 467-498. doi:10.1039/CS9871600467.
^ Tom Sidney Moore and Thomas Field Winmill (1912). “CLXXVII.—The state of amines in aqueous solution”. J. Chem. Soc., Trans. 101: 1635. doi:10.1039/CT9120101635.
- ^ abWendell M. Latimer, Worth H. Rodebush (1920). “Polarity and ionization from the standpoint of the lewis theory of valence”. J. Am. Chem. Soc. 42 (7): 1419–1433. doi:10.1021/ja01452a015.
- ^ abW. L. Jorgensen and J. D. Madura (1985). “Temperature and size dependence for Monte Carlo simulations of TIP4P water”. Mol. Phys. 56 (6): 1381. doi:10.1080/00268978500103111.
^ Jan Zielkiewicz (2005). “Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water”. J. Chem. Phys. 123 (10): 104501. doi:10.1063/1.2018637. PMID 16178604.
^ Michel Baron, Sylviane Giorgi-Renault, Jean Renault, Patrick Mailliet, Daniel Carré et Jean Etienne (1984). “Hétérocycles à fonction quinone. V. Réaction anormale de la butanedione avec la diamino-1,2 anthraquinone; structure cristalline de la naphto [2,3-f] quinoxalinedione-7,12 obtenue”. Can. J. Chem. 62 (3): 526–530. doi:10.1139/v84-087.
^ Damien Laage and James T. Hynes (2006). “A Molecular Jump Mechanism for Water Reorientation”. Science 311 (5762): 832. doi:10.1126/science.1122154. PMID 16439623.
^ Omer Markovitch & Noam Agmon (2008). “The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water”. Molecular Physics 106: 485. doi:10.1080/00268970701877921.
- ^ abR. H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, Thomas F. Koetzle (1996). “A New Intermolecular Interaction: UnconventionalHydrogen Bonds with Element−Hydride Bonds as ProtonAcceptor”. Acc. Chem. Res. 29 (7): 348–354. doi:10.1021/ar950150s.
^ E. D. Isaacs, A. Shukla, P. M. Platzman, D. R. Hamann, B. Barbiellini, and C. A. Tulk (1999). “Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement”. Phys. Rev. Lett. 82: 600-603. doi:10.1103/PhysRevLett.82.600.
^ Dingley, A. J.; Grzesiek, S. (1998). “Direct Observation of Hydrogen Bonds in Nucleic Acid Base Pairs by Internucleotide 2JNN Couplings”. J. Am. Chem. Soc. 120 (33): 8293–8297. doi:10.1021/ja981513x.
^ F. Cordier, M. Rogowski, S. Grzesiek and A. Bax (1999). “Observation of through-hydrogen-bond 2hJHC‘ in a perdeuterated protein”. J. Magn. Reson. 140 (2): 510–2. doi:10.1006/jmre.1999.1899. PMID 10497060.
^ Cordier, F.; Grzesiek, S. (1999). “Direct Observation of Hydrogen Bonds in Proteins by Interresidue 3hJNC‘ Scalar Couplings”. J. Am. Chem. Soc. 121 (7): 1601–1602. doi:10.1021/ja983945d.
^ “Law-breaking liquid defies the rules”. physicsworld.com (2004年9月24日). 2011年3月13日閲覧。
参考文献
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13, 1997). ISBN 0-19-509549-9
Robert H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, and Thomas F. Koetzle (1996). “A New Intermolecular Interaction: Unconventional Hydrogen Bonds with Element-Hydride Bonds as Proton Acceptor”. Acc. Chem. Res. 29 (7): 348–354. doi:10.1021/ar950150s. PMID 19904922.
Alexander F. Goncharov, M. Riad Manaa, Joseph M. Zaug, Richard H. Gee, Laurence E. Fried, and Wren B. Montgomery (2005). “Polymerization of Formic Acid under High Pressure”. Phys. Rev. Lett. 94 (6): 065505. doi:10.1103/PhysRevLett.94.065505. PMID 15783746.
R. Parthasarathi, V. Subramanian, N. Sathyamurthy (2006). “Hydrogen Bonding Without Borders: An Atoms-In-Molecules Perspective”. J. Phys. Chem. A 110 (10): 3349–3351. doi:10.1021/jp060571z. PMID 16526611.
Z. Liu, G. Wang, Z. Li, R. Wang (2008). “Geometrical Preferences of the Hydrogen Bonds on Protein−Ligand Binding Interface Derived from Statistical Surveys and Quantum Mechanics Calculations”. J. Chem. Theory Comput. (A) 4 (11): 1959–1973. doi:10.1021/ct800267x.
M. Goswami, E. Arunan (2009). “The Hydrogen bond: A Molecular Beam Microwave Spectroscopist's View with a Universal Appeal”. Phys. Chem. Chem. Phys. 11: 8974–8982. doi:10.1039/b907708a.
関連項目
- 共有結合
- イオン結合
- 水素結合結晶
- 分子間力
- 電気陰性度
| ||||||||||||||||||||||||||

