六フッ化硫黄
| 六フッ化硫黄(六弗化硫黄) | |
|---|---|
 | |
 |  |
IUPAC名 六フッ化硫黄 | |
| 識別情報 | |
CAS登録番号 | 2551-62-4 |
国連/北米番号 | |
RTECS番号 | WS4900000 |
SMILES
| |
| 特性 | |
化学式 | SF6 |
モル質量 | 146.06 g/mol |
| 外観 | 無色気体 |
密度 | 6.164 g/L, 気体[1] 1.329 g/ml, 液体 (25 ℃)[2] 2.510 g/cm3, 固体 (-50.8 ℃) |
沸点 | -64 ℃, 209 K(昇華) |
水への溶解度 | 微溶 |
| 構造 | |
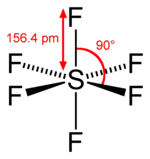
配位構造 | 八面体形 (Oh) |
双極子モーメント | 0 |
| 危険性 | |
安全データシート(外部リンク) | External MSDS |
主な危険性 | 高濃度で窒息の危険性 |
| 関連する物質 | |
| その他の陽イオン | 六フッ化セレン 六フッ化テルル |
| 関連する硫黄フッ化物 | 二フッ化二硫黄 二フッ化硫黄 四フッ化硫黄 十フッ化二硫黄 |
| 関連物質 | フッ化スルフリル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
六フッ化硫黄(ろくフッかいおう、sulfur hexafluoride)は、化学式 SF6 で表される硫黄の六フッ化物である。硫黄原子を中心にフッ素原子が正八面体構造をとっている。
常温常圧においては化学的に安定度の高い無毒、無臭、無色、不燃性の気体で、大気中での寿命は 3,200年である。1960年代から電気および電子機器の分野で絶縁材などとして広く使用されている化学物質で、人工的な温室効果ガスとされる。使用量はそれほど多くないが、近年新たな用途開発の進展に伴い需要量が増加している。100年間の地球温暖化係数は二酸化炭素の23,900倍と大きくかつ大気中の寿命が長いため、HFCs、PFCsと共に京都議定書で地球温暖化防止排出抑制対象ガスの1つに指定された。大気への放出はほぼ全て人為的なものと考えられている。

マウナロアで観測された大気中濃度の推移グラフ
目次
1 特徴
2 用途
2.1 工業用
2.2 医療用
3 合成法と化学
4 その他
5 国内状況
6 注釈・出典
7 関連項目
8 外部リンク
特徴
融点 -50.8±0.2°C、昇華点 -63.8°C で、1個の硫黄原子 (S) と6個のフッ素原子 (F) からなる無色無臭の気体。空気を1としたときの比重は 5.106[1]。熱的、化学的に安定で、耐熱性、不燃性、非腐食性に優れ、また高い絶縁性能[3]を有している。
用途
工業用
高い絶縁性能を有しているため、ガス変圧器、ガス遮断器、ガス絶縁開閉装置などの電力機器において絶縁体や消弧媒体として利用されている。他にはマグネシウム合金溶解炉の酸化防止用途や、半導体製品や液晶パネルのドライエッチング工程でも用いられている。特殊な例としてリチウムと組み合わせて魚雷用エンジンの燃料にも用いられている。
医療用
眼科領域の手術の際に用いられる。SF6 を眼内に注入すると空気よりも長期間とどまる性質があるため、網膜剥離などの網膜硝子体疾患の手術(硝子体手術)の際にガスの浮力を利用して網膜を一定期間押し付ける目的で使用されることがある。
合成法と化学
分子を構成する元素の単体、すなわち S8 と F2 から合成することができる。他のフッ化硫黄類も副生するが、S2F10 は加熱による不均化、SF4 は水酸化ナトリウム水溶液での洗浄による分解でそれぞれ除去される。
- S2F10⟶SF6 +SF4{displaystyle {ce {S2F10 -> SF6 + SF4}}}
- SF4 +2NaOH +H2O⟶Na2SO3 +4HF{displaystyle {ce {SF4 + 2 NaOH + H2O -> Na2SO3 + 4 HF}}}
またSF4 を原料として SF5Cl を合成することができる。構造は SF6と類似するが、強い酸化剤であり、加水分解されて硫酸となる。
SF6 の反応はあまり知られていない。溶融した金属ナトリウムとも反応しない。これは、硫黄中心が正八面型に配置するフッ素で覆われていることと、分子全体の極性がほとんど無いことに由来する。
特筆するものとしては、魚雷の推進機関にて利用される金属リチウムとの反応がある。[4]
- 8Li +SF6⟶6LiF +Li2S{displaystyle {ce {8Li + SF6 -> 6LiF + Li2S}}}
反応によって生じた熱エネルギーと海水から水蒸気を生成させ、これを推進力としている。また反応生成物の体積は元の六フッ化硫黄とリチウムよりも小さくなる事から、従来の魚雷のように生成物を機外に排出する必要が無く、魚雷の性能向上に寄与している[5]。
その他
SF6 を吸い込み声を出すと音域が低くなる[6]。これは、空気と比重の異なる気体中では音速が変化するので呼吸器における共鳴周波数が変わる(空気より軽い気体では高く、重い気体では低くなる)ことに起因する[7]。
2007年に気象庁気象研究所が海水中の六フッ化硫黄濃度を高精度かつ低検出限界で測定できる手法を開発した[8]。
国内状況
日本国内で SF6 を製造しているのは、AGC株式会社、関東電化工業株式会社のみである。[要出典]
注釈・出典
- ^ abSchumb, W. C.; Gamble, E. L. "The preparation of sulfur hexafluoride and some of its physical properties." J. Am. Chem. Soc. 1930, 52, 4302-4308.
^ Merck Index 14th ed., 8973.
^ 絶縁性能を評価する物理量の一つとしてパッシェンの法則における最小火花電圧があるが、空気の値が 355V であるのに対し六フッ化硫黄の場合は 459V という測定報告がある。(『SF6 ガスの最小火花電圧』鳳誠三郎他、成蹊大学工学報告 No.18(1974)1367-1368頁), NAID 110001048517
^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). “Stored Chemical Energy Propulsion System for Underwater Applications”. Journal of Energy 7 (2): 128–133. doi:10.2514/3.62644.
^ 高水圧下では生成物の排出が困難であるため、推進性能や限界深度に制限があった
^ "Fun With Gas" (YouTube) - Mythbusters, DiscoveryNetwork
^ なお、肺に吸入した気体をすべて吐き出せるわけではない(肺活量の記事を参照のこと)ので、無毒であっても空気以外の気体を吸入する場合は酸素欠乏による窒息死の危険性に常に留意する必要がある。特に重い気体は肺底部に留まりやすいので危険性がより大きい。軽い気体なら比重差により排出されやすい。
^ 気象研究所技術報告 第51号 大気および海水中の超微量六フッ化硫黄 (SF6) の測定手法の高度化と (SF6) 標準ガスの長期安定性の評価 気象庁気象研究所
関連項目
- 温室効果ガス
- フッ化硫黄
- 超原子価
外部リンク
MSDS SF6 (PDF) AGC株式会社
MSDS SF6 (PDF) 高千穂化学工業株式会社
声が変わる実験 "MythBusters - Fun With Gas" Youtube 投稿映像
| ||||||||


